Ácidos y bases. Teoría de Lewis Física Química
Diagrama De Lewis Hcn Estudiar

Todos los cationes son ácidos de Lewis, ya que pueden aceptar electrones. Los ejemplos incluyen cobre (Cu2), hierro (Fe2 + y Fe3 +) e iones de hidrógeno (H +). Un átomo, ion o molécula con un octeto incompleto de electrones puede aceptar electrones. Los ejemplos incluyen trifluoruro de boro (BF3) y fluoruro de aluminio (AlF3).
Ácidos y bases. Teoría de Lewis Física Química

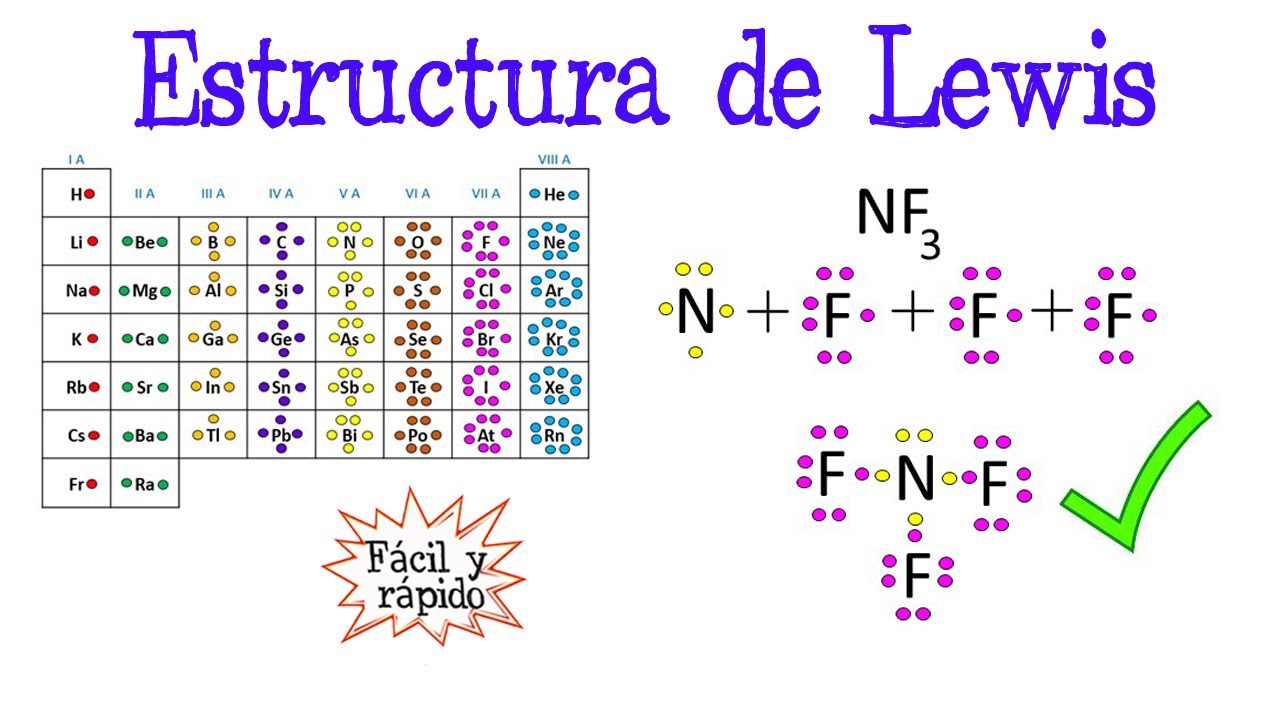
La estructura de Lewis es toda aquella representación de los enlaces covalentes dentro de una molécula o un ion. En ella, dichos enlaces y los electrones se representan con puntos o guiones largos, aunque la mayoría de las veces los puntos corresponden a los electrones no compartidos y los guiones a los enlaces covalentes.
Ejercicios resueltos estructuras de Lewis Física Química

El modelo atómico de Lewis, también conocido como la estructura de Lewis, es un método utilizado para representar la distribución de electrones en un átomo o una molécula. Fue propuesto por el químico estadounidense Gilbert N. Lewis en 1916. Según el modelo de Lewis, los átomos están formados por un núcleo central que contiene protones y neutrones, y los electrones se distribuyen en.
Ácidos y bases. Teoría de Lewis Física Química

Una reacción ácido-base de Lewis ocurre cuando una base dona un par de electrones a un ácido. Se forma un , un compuesto que contiene un enlace covalente coordinado entre el ácido de Lewis y la base de Lewis. Las siguientes ecuaciones ilustran la aplicación general del concepto de Lewis. El átomo de boro en trifluoruro de boro, BF 3.
PPT CHAPTER 10 Reactions in Aqueous Solutions I Acids, Bases & Salts PowerPoint Presentation
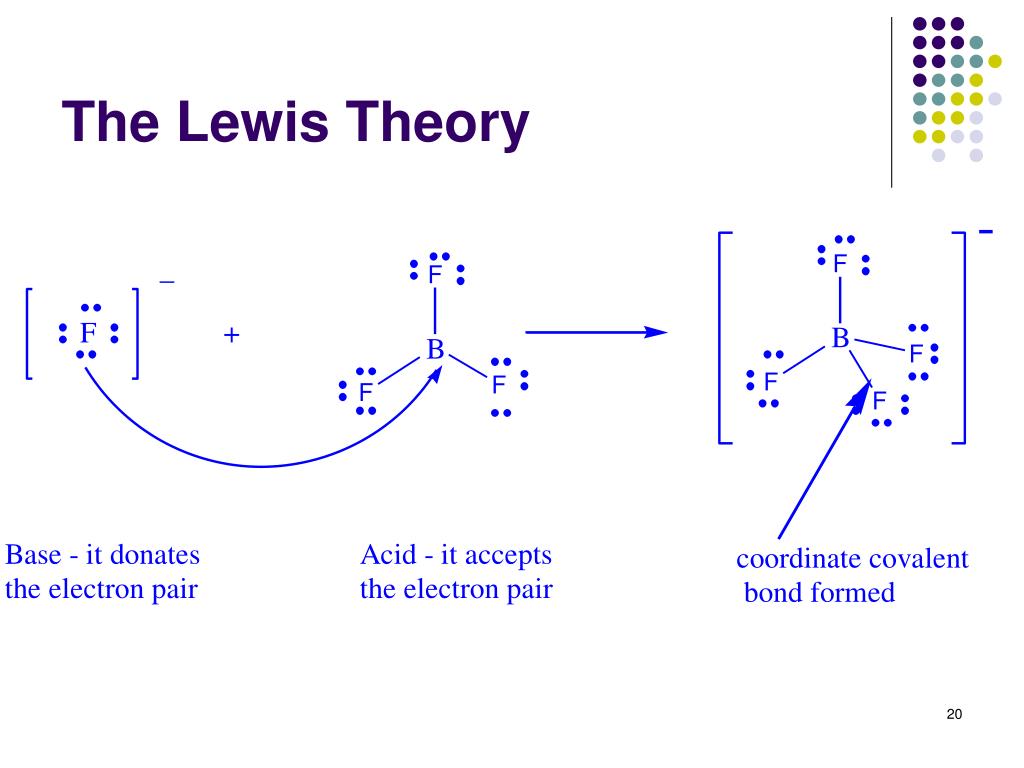
La reacción de un ácido de Lewis y una base de Lewis producirá un enlace covalente coordinado, como se muestra en la Figura 1.12.1 1.12. 1 anterior. Un enlace covalente coordinado es solo un tipo de enlace covalente en el que un reactivo le da par de electrones a otro reactivo. En este caso la base lewis dona sus electrones al ácido de Lewis.
Comprender mas sobre Cual Es La Estructura De Lewis La fisica y quimica
Teoría de Lewis. Gilbert Newton Lewis fue un fisicoquímico estadounidense reconocido por crear la estructura de Lewis o diagramas de punto. Famoso por su gran aporte a la fisicoquímica y más aún por ser inspiración para muchas mentes de la investigación tales como Linus Pauling. Desarrolló el estudio de los electrones periféricos de.
Acidos Y Bases De Lewis Ejemplos Resueltos Opciones de Ejemplo

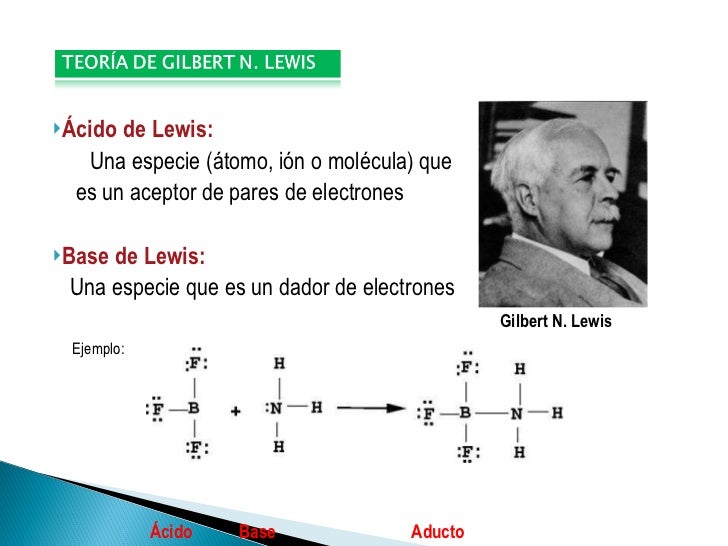
Según como transfieren dichos electrones, Lewis definió a los ácidos y las bases como: Base de Lewis: sustancia que puede compartir o donar un par de electrones. Ácido de Lewis: sustancia que acepta o toma un par de electrones. De esta manera, el ácido se queda con su octeto de electrones incompleto y la base tiene un par de electrones.
Símbolo de punto de Lewis (Estructura de Lewis / representación de Lewis) en átomos. YouTube

¿Alguna vez has oído hablar de la teoría ácido-base Lewis? Si eres un estudiante de química, probablemente sí. Pero, incluso si no lo eres, ¡no te preocupes! Esta teoría es fascinante y relevante para entender una serie de reacciones químicas importantes en nuestro mundo. En este artículo, te sumergirás en la teoría ácido-base Lewis y aprenderás todo lo que necesitas saber sobre.
Diagrama de Lewis ️ Teoría, estructura, ejercicios y ejemplos
La teoría de ácidos y bases de lewis es un modelo conceptual importante que describe cómo los electrones son compartidos entre moléculas y cómo esto afecta a su reactividad. A través de esta teoría, podemos entender una amplia variedad de fenómenos químicos y utilizarla en la síntesis de compuestos orgánicos y en la catálisis de.
ÁCIDO y BASE CLASE
Débil. Diagrama de algunas bases y ácidos. Un ácido de Lewis es una especie química que contiene un orbital vacío que es capaz de aceptar un par de electrones de una base de Lewis para formar un aducto de Lewis. Una base de Lewis, entonces, es cualquier especie que tiene un orbital lleno que contiene un par de electrones que no está.
Las estructuras de Lewis definición y características YuBrain

En 1923, G.N. Lewis propuso una definición general para el comportamiento de ácido-base en el cual los ácidos y las bases se identifican por su habilidad de aceptar o donar un par de electrones y formar un enlace covalente de coordinación. Un enlace covalente de coordinación (o enlace dativo) ocurre cuando uno de los átomos en el enlace.
Teoria acido base Lewis YouTube

La teoría de Lewis establece que los átomos tienden a alcanzar una estructura electrónica estable en la que los electrones se distribuyen de manera equilibrada. Para ello, los átomos pueden compartir electrones entre sí, formando enlaces covalentes, o transferir electrones, formando enlaces iónicos. En la teoría de Lewis, los electrones.
¿Qué es una estructura de Lewis? Definición y ejemplo

Lewis explicó que en muchas reacciones que forman nuevos enlaces, ambos electrones en el nuevo enlace provienen de 1 átomo (o 1 reactivo) solamente, en lugar de 1 electrón proveniente de cada uno. Llamó a todas estas reacciones reacciones ácido-base. La imagen muestra el agua que se forma a partir de los elementos, en un proceso redox, y.
Ácidos e bases de Lewis Química Orgânica Biologia YouTube
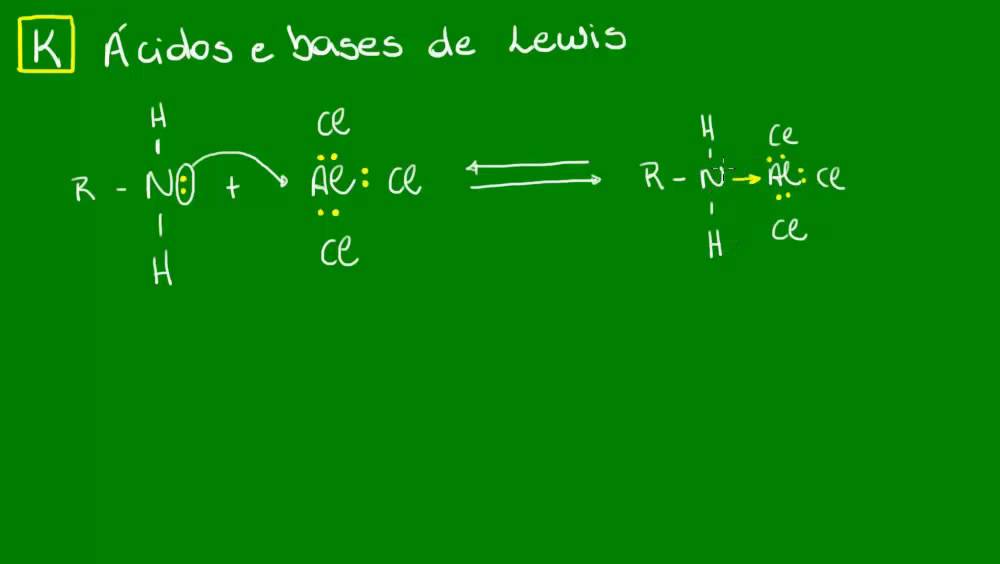
En 1923, Lewis propone una teoría para explicar el comportamiento de las sustancias ácidas y básicas. Esto es debido a que en las Teorías anteriores como la de Brønsted-Löwry, definían a estas en función de aceptar/ceder protones ( H⊕ ). Sin embargo, se conocían sustancias que, careciendo de hidrógeno en su molécula como SO 3 y CO.
PPT Teorías ÁcidoBase PowerPoint Presentation, free download ID2199708

La estructura de Lewis está basada en la regla del octeto, en la cual, los átomos comparten electrones y cada uno cuenta con 8 electrones en su capa externa. Tomando como ejemplo el átomo de oxígeno se sabe que tiene 6 electrones en su capa externa, de manera que en la estructura de Lewis, los 6 puntos se disponen de manera que haya dos.
Ácidos y Bases de Lewis Ácidos y bases Química Wikisabio

Los ácidos de Lewis corresponden a una teoría de ácidos-bases planteada por Gilbert Lewis a principios del siglo XX, en donde "un ácido es una sustancia química capaz de compartir o aceptar un par de electrones", y "una base un elemento apto para compartir o dar pares de electrones".. Conforme a ello, la reacción de los ácidos de Lewis con una base, daría como resultado un.